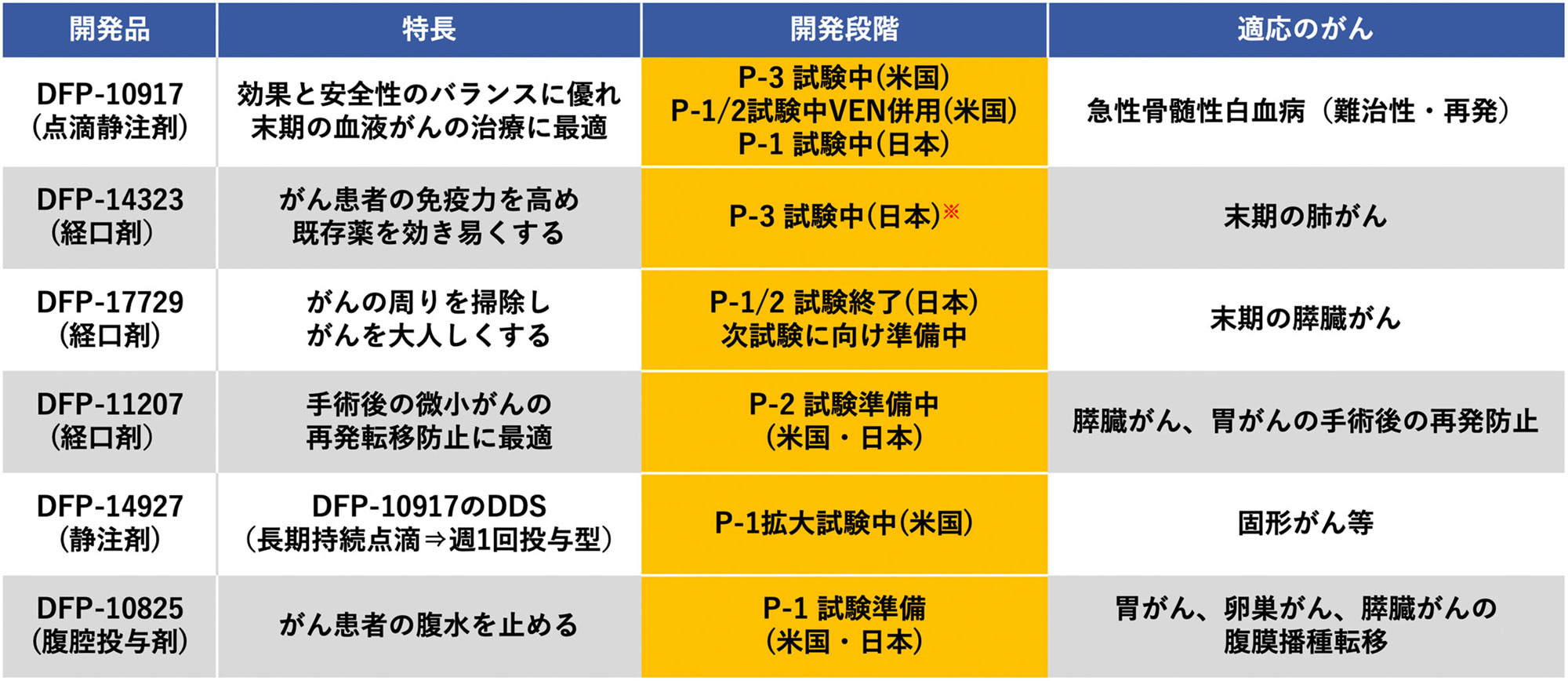
1) DFP-10917
- 対象疾病
- 難治性・再発急性骨髄性白血病
- 特 長
- 投与量を低用量・長時間とし、投与経路も点滴による持続静注とした新規のデオキシシチジン誘導体
(2024 年11 月現在)
Uncommon EGFR遺伝子変異陽性非小細胞肺癌患者を対象としたアファチニブ投与におけるDFP-14323を併用した際の有効性を検証する臨床第III相試験:詳細につきましては臨床試験登録サイト jRCT2061230111 をご参照ください。

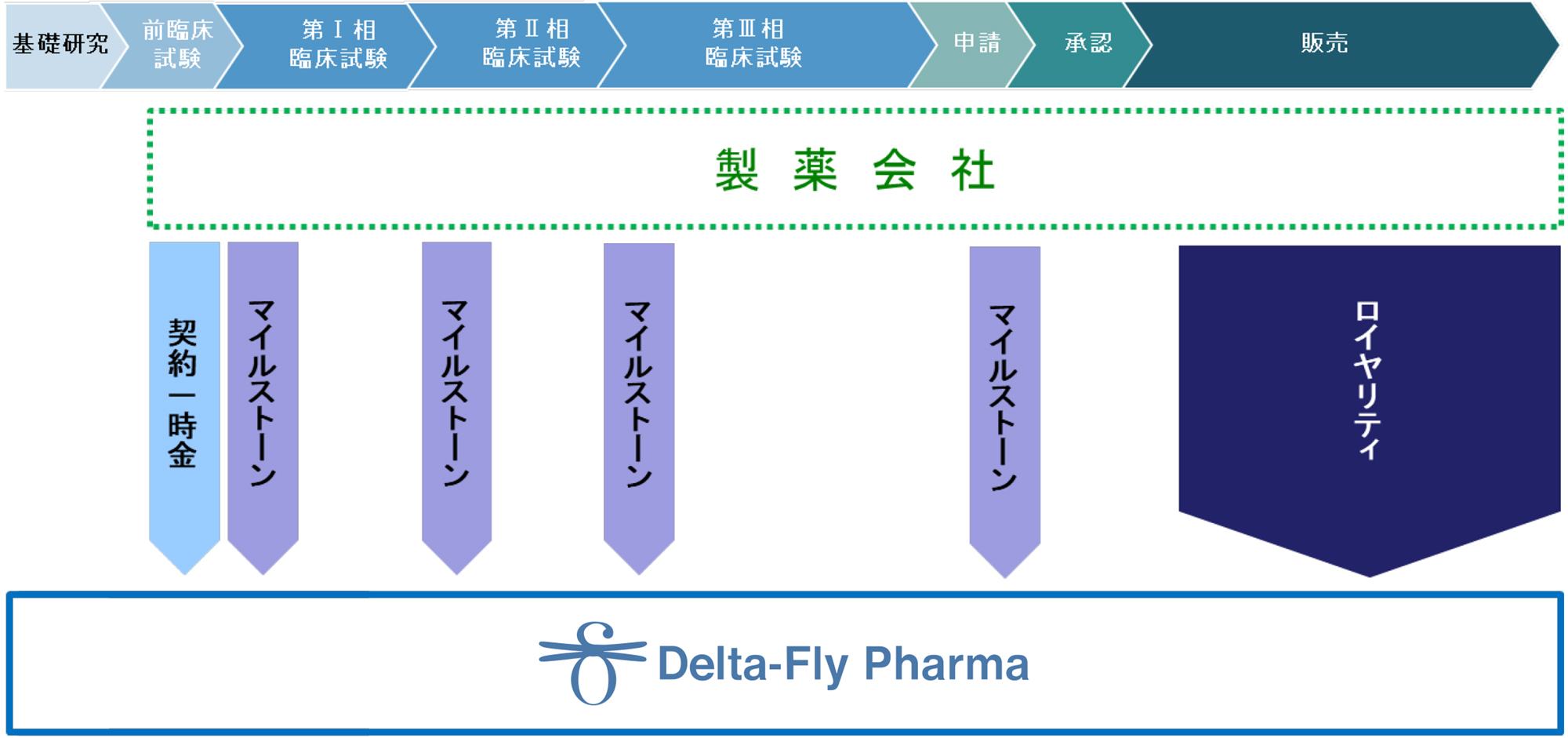
| 収益名 | 内容 |
|---|---|
| 契約一時金 | 契約締結時に一時金として受取る収入 |
| マイルストーン | 研究開発の進捗に応じて、事前に設定したイベントを達成した際に受取る収入 |
| 開発協力金 | 研究開発費用に応じ、提携会社が負担する分の収入 |
| ロイヤリティ | 医薬品販売後に売上高に応じて受取る収入 |
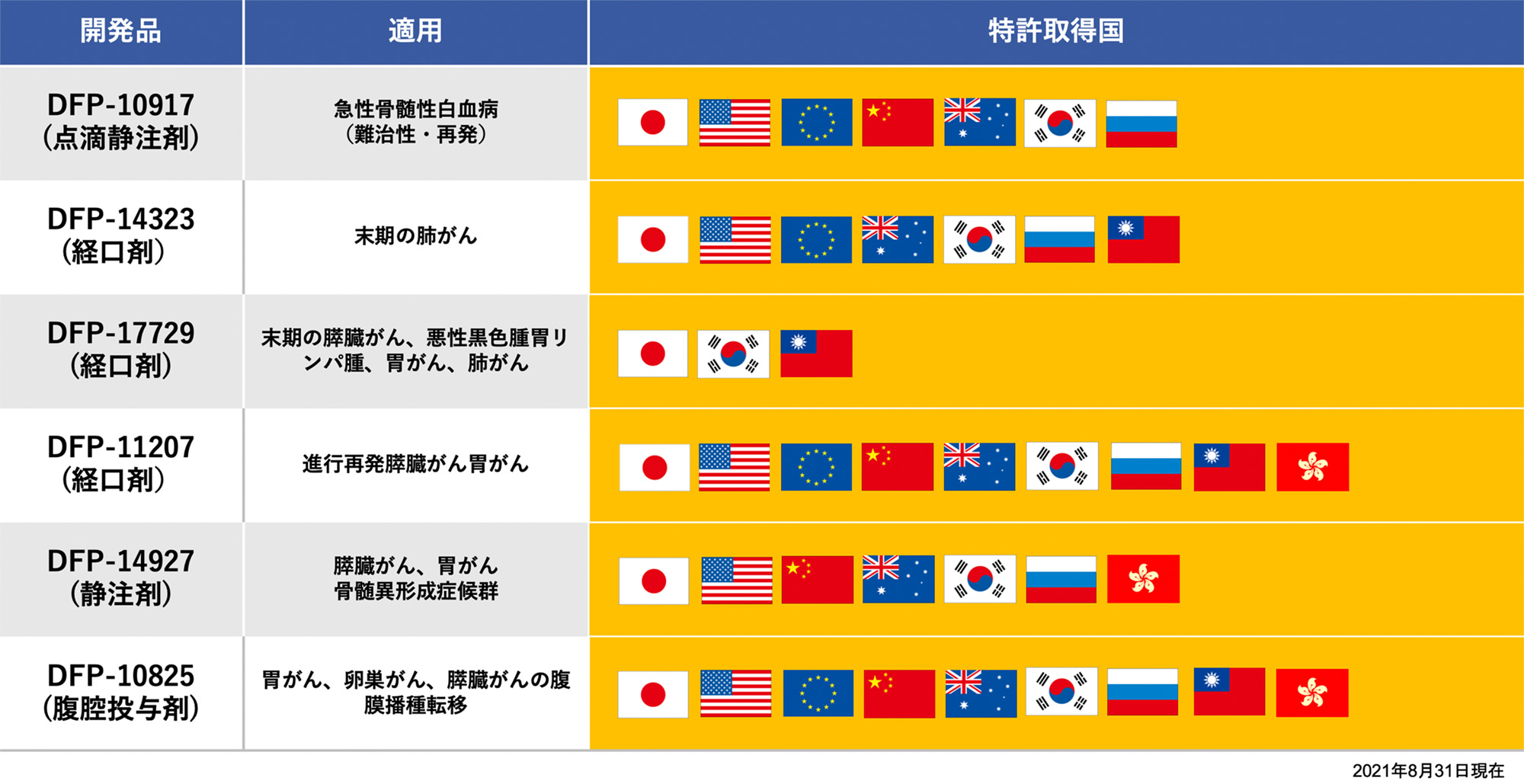
| 開発品 | パートナー名称 | 国名 | 契約品目 | 契約締結日 | 契約内容 | 契約期間 |
|---|---|---|---|---|---|---|
| DFP-10917 | 日本新薬㈱ | 日本 | 医薬品製造販売 | 2017年3月24日 | DFP-10917の 独占的特許実施許諾 |
日本における特許権が消滅するまで又は販売開始後15年のいずれか遅い方まで |
| DFP-17729 | 日本ケミファ㈱ | 日本 | 医薬品製造販売 | 2020年3月26日 | DFP-17729の 独占的特許実施許諾 |
日本ケミファ㈱及びサブライセンシーが本製品の販売を終了するまで |
| DFP-14323 | 日本ケミファ㈱ | 日本 | 医薬品製造販売 | 2022年3月8日 | DFP-174323の 独占的特許実施許諾 |
日本ケミファ㈱及びサブライセンシーが本製品の販売を終了するまで |